高校の理論化学:
周期表と電気陰性度のまとめ
$\require{mhchem}$
電気陰性度とは、原子がどれだけ電子を引き寄せて化学結合を形成するかを示す指標です。「電気陰性度が高い」とは、原子が電子を引き寄せて化学結合を形成しやすいことを意味します。「電気陰性度が低い」とは、原子が電子を容易に供与して結合を形成したり、電気的に陽性になったりすることを意味します。
教科書には周期表の元素の電気陰性度の表が書いてありますが、一般に、原子の電気陰性度には決まった値がありません。電気陰性度の大小は分子内の他の原子にも依存し、核電荷や電子の数にも依存します。
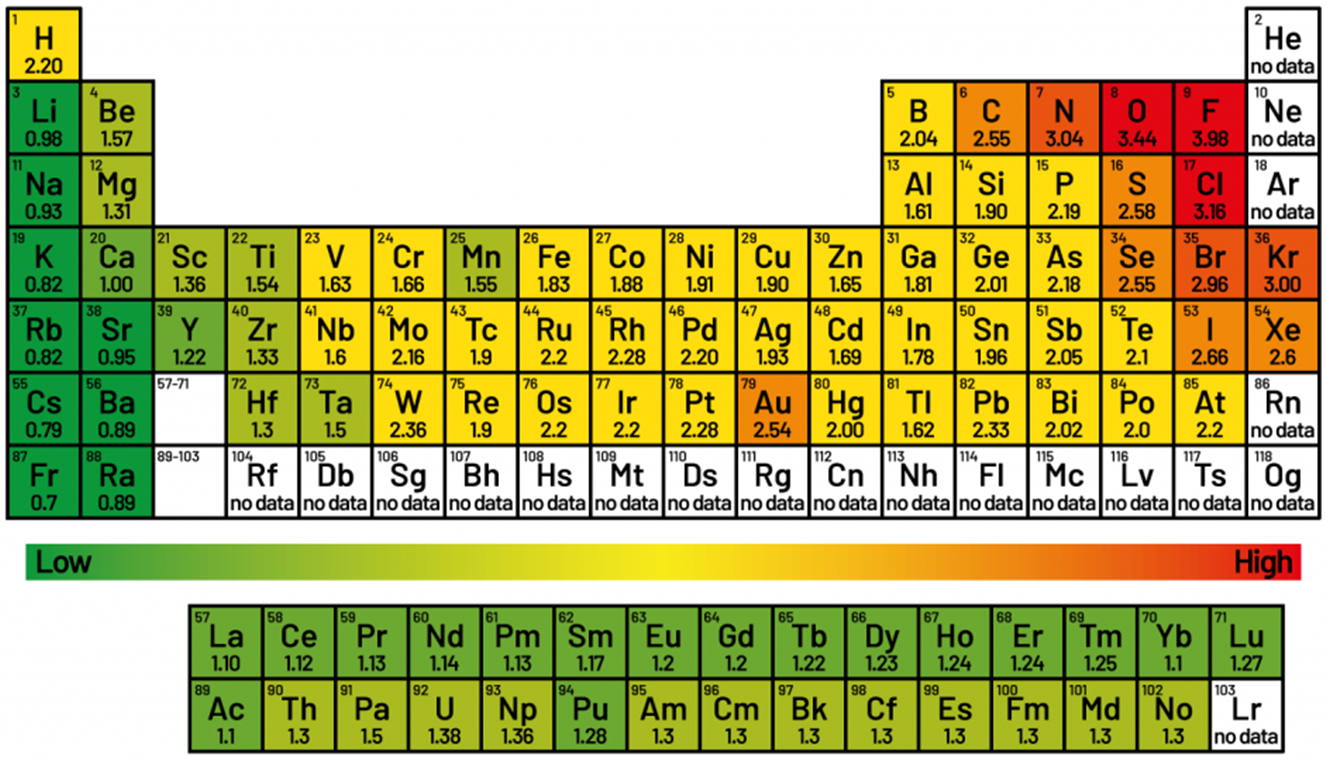 図.電気陰性度の一覧
図.電気陰性度の一覧
電気陰性度を計算する最も一般的な方法は、アメリカ合衆国の量子化学者であるライナス・ポーリング(1901~1994年)によって提案されたポーリングスケールです。ポーリングスケールは0.79から3.98まであります。フッ素を4.0とする流儀もありますが、ほとんど4.0として覚えておいて良いでしょう。電気陰性度はあくまでも相対的な値です。
最も電気的に陰性な元素はフッ素であり、電子陰性値はポーリングスケールで3.98(4.0)です。一方で最も電気的に陽性な元素はフランシウムです。高校の範囲ではセシウムが最も電気陰性度が低い元素として、電気陰性度は0.79です。イオン化エネルギーが高いので、フランシウムはセシウムよりもさらに電気的に陽性であると考えられます。フランシウムの電気陰性度は0.7前後と推定されていますが、実験的に測定されたことはありません。
電気陰性度と化学結合
電気陰性度の値を比較することで、2つの原子がどのような化学結合を形成するかを予測することができます。同じ電子価数の原子($\ce{H2}$、$\ce{N2}$など)は共有結合を形成します。電子基価がわずかに異なる原子($\ce{CO}$、$\ce{H2O}$など)は極性の共有結合を形成します。すべてのハロゲン化水素($\ce{HCl}$、$\ce{HF}$など)は極性共有結合を形成します。電気陰性度の値が非常に異なる原子($\ce{NaCl}$など)はイオン結合を形成します。電気陰性度は、化学結合が実際に形成されるかどうかの予測には役に立たないことに注意してください。アルゴンは電気陰性度が高く、希ガスでありながら化学結合を形成することはほとんどありません。
マリケンの定義によれば、電気陰性度は第一イオン化エネルギーと電子親和力の和に比例します。$$\text{電気陰性度}=\dfrac{\text{イオン化エネルギー}+\text{電子親和力}}{2}$$
ポーリングの定義では原子Aと原子Bの結合エネルギーの実測値から求められています。$$\varDelta(AB)=E(AB)-\dfrac{1}{2}{(E(AA)+E(BB))}$$例えば$E(AB)$は原子Aと原子Bの結合エネルギーであり、$E(AA)$は原子Aと原子Aの結合エネルギーです。
周期表における電気陰性度の傾向
電気陰性度は、アルカリ金属からハロゲンまで、周期を挟んで左から右に向かって増加していきます。ただし遷移金属は例外です。また、電気陰性度は周期表の族の下に行くほど減少します。これは、原子核と価電子の距離が長くなるためです。同じ族の元素では高周期のものほど電気陰性度が大きくなります。
電気陰性度はイオン化エネルギーと同じ一般的な傾向を示します。イオン化エネルギーが低い元素は電気陰性度が低い傾向にあります。同様に、イオン化エネルギーが高い元素は電気陰性度が高い傾向があります。これは電気陰性度の定義を考えると明らかですね。
語呂合わせで「フォン黒豚死す」という覚え方がありますが、これは$$\ce{F>O>N>Cl>Br>C>S>H}$$という順序になっていることをアレンジしたものです。しかしこの覚え方はヨウ素が含まれていないのが難点である上、$\ce{N}$と$\ce{Cl}$の順序と$\ce{C}$と$\ce{S}$の順序が間違っているので使いものになりません。
電気陰性度と言えば、2015年の東大理科の化学で酸化力の順序が$$\mathrm{F}_{2}>\mathrm{O}_{2}>\mathrm{Br}_{2}>\mathrm{I}_{2}>\mathrm{S}$$となることを答えさせる設問が出題されたことがあります。それなりに予備知識の必要な推論が要求されるため、難しい問題だったと思います。電気陰性度はヨウ素も含めて$$\ce{F>O>Cl>N>Br>I>S>C≈Se>H}$$と覚えておくべきです。この上位10元素はできれば小数点以下第2位まで覚えておきましょう(セレンは覚えなくても良いかもしれません)。
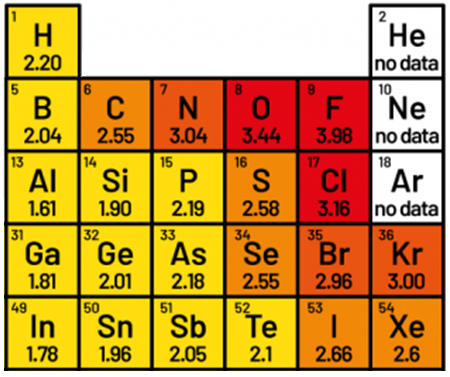 図.周期表の抜粋
図.周期表の抜粋
なお、クリプトン、キセノン、ラドンは化合物を作るので希ガス元素としては例外的に電気陰性度が定義できます。それぞれ Kr:3.0、Xe:2.6、Rn:2.2 という値になります。
