こんにちは。管理人のpencilです。
今回は高校化学で苦手とする人の多い「不斉」という性質について解説します!
有機化学の分野で登場する不斉炭素原子についても詳しく説明します!
不斉炭素原子を理解するためには、「不斉」の意味と「炭素原子」の性質について理解しておく必要があります。そこでまず炭素原子の性質をおさらいします。$\require{mhchem}$
炭素原子には手が4本ある
炭素は原子番号6の元素であり、電子を6個持っています。その内訳は、K殻に2個、L殻に4個となっていて、L殻は最外殻なので炭素原子の最外殻電子数は4となります。
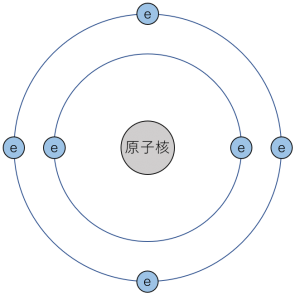
図1.炭素の電子配置
これは4本の共有結合を作れることを意味しており、これが「炭素原子には手が4本ある」(=結合相手が4つ)ということの理由になっています。
例えば、メタン($\ce{CH4}$)を考えればわかる通り、C-H結合はいずれも共有結合で、その数は4本ですね。
図2.メタン
※3Dモデルは操作できます
(読み込めないときはページを再読み込みして下さい)
このような炭素の性質により、現在では数億という膨大な数の有機化合物が知られています。そのうち多数の化合物が不斉炭素原子を有しています。
不斉:鏡像とキラリティ(対掌性)
不斉というのは英語で “asymmetry” を意味し「対称でない」ということを表しています。有機化学で頻繫に登場する不斉炭素とは、4つの結合手が異なる原子または置換基と共有結合しているような炭素を指します。
「対称でない」というのはどういうことでしょうか?
まず下の図3を見て下さい。
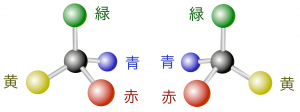 図3.互いに鏡像の分子
図3.互いに鏡像の分子
この2つの分子の組成は同じですが、構造は鏡写しの関係にあり、互いに鏡像(鏡を介して対称)の関係になっています。このように、鏡像の関係にあり、結合を切断して繋ぎ変えない限り重ね合わせることができないような異性体を「鏡像異性体」と言います。最近ではこのような鏡像と重ね合わせられない化合物を
「エナンチオマー」
と呼ぶことが推奨されています(「国際純正・応用化学連合(通称:IUPAC)」という世界中の化学者からなる国際的な組織によって推奨されています)。
このような「鏡像と重ね合わせられない性質」を「キラリティ」(chirality)と言います(「カイラリティ」と発音する人もいます)。ちょうど掌(てのひら)が左右対称で鏡像の関係にあることから、「掌性」あるいは「対掌性」とも呼ばれます。また、図2の分子の黒い原子は「キラリティ」を生じる幾何学的「中心」なので「キラル中心」もしくは「不斉中心」と呼ばれます。
“asymmetry” の意味するところは「分子内では対称でない」ということであり、エナンチオマー同士は鏡に関して対称になります。端的にキラリティという性質を述べると以下のようになります。
「キラリティ」とは
鏡写しの関係にあり、互いに重ね合わせられない性質
● ● ●
実際に3Dのモデルで確認してみましょう。例えば、
図4.4置換体分子A
という4置換体の分子Aと、
図5.4置換体分子B
4置換体の分子Bは鏡像の関係にあり、結合を切断して繋ぎ変えない限り、重ね合わせることができません。したがって、この2分子はキラルな分子であり、互いにエナンチオマーの関係にあります。
不斉炭素原子とメソ体・ラセミ体
不斉炭素原子は「不斉中心を作る炭素原子」を指しており、基本的には4つの手の先に異なる原子や置換基を有する炭素原子が該当します。この不斉炭素原子が存在することによって分子にキラリティが生じるのです。
普通、構造式上では不斉炭素原子にアスタリスク「*」を付けて他の炭素原子と区別します。以下の図ではそのように表記してあります。
例)乳酸(lactic acid)
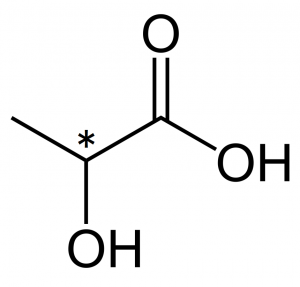 図6.乳酸の構造式
図6.乳酸の構造式
($\ce{C^{\ast}}$は1個)
乳酸は教科書でも紹介されることの多い代表的なエナンチオマーです。
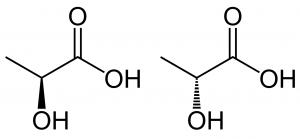
図7.乳酸の構造
(左がS体、右がR体)
図8.L-(+)-lactic acid((S)-lactic acid)
図9.D-(-)-lactic acid((R)-lactic acid)
● ● ●
例)リモネン(limonene)
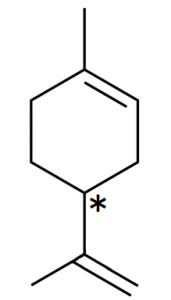 図10.リモネンの構造式
図10.リモネンの構造式
($\ce{C^{\ast}}$は1個)
リモネンは果物のレモンに含まれる化合物で、柑橘系の香りが特徴的です。6員環内に二重結合が存在するため、イソプロペニル基の付け根に不斉炭素原子が生じます。
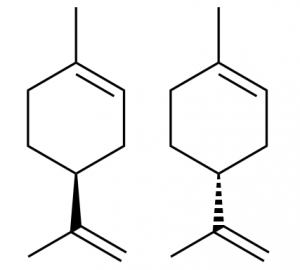
図11.リモネンの構造
(左がS体、右がR体)
図12.L-limonene
((S)-limonene)
図13.D-limonene
((R)-limonene)
● ● ●
例)アドレナリン(adrenaline)
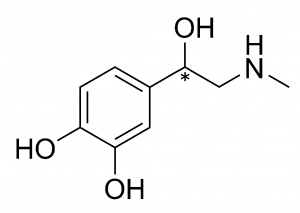
図14.アドレナリンの構造式
($\ce{C^{\ast}}$は1個)
アドレナリンは交感神経が興奮すると分泌されるホルモンで、神経節や脳神経系における神経伝達物質として働きます。実はアドレナリンにもエナンチオマーが存在します。
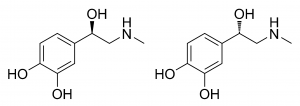
図15.アドレナリンの構造
(左がR体、右がS体)
図16.L-adrenaline
((R)-adrenaline)
図17.D-adrenaline
((S)-adrenaline)
● ● ●
一般に、不斉炭素原子が$n$個存在する分子にはエナンチオマーが$2^n$個だけ存在しますが、世の中にはより少ないエナンチオマーしか存在ない化合物も知られています。
例)酒石酸(tartaric acid)
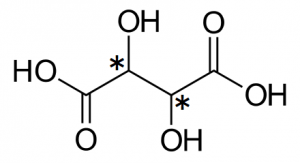 図18.酒石酸の構造式
図18.酒石酸の構造式
($\ce{C^{\ast}}$は2個)
酒石酸には不斉炭素原子が2個存在するのでエナンチオマーは4個存在しそうに思われます。ところが酒石酸は分子内に鏡面をもつため、鏡像が相殺されて1つ減ります(酒石酸の(S,R)体と(R,S)体は共通)。
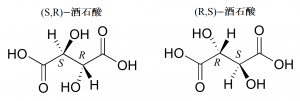
図19.酒石酸の(S,R)体と(R,S)体
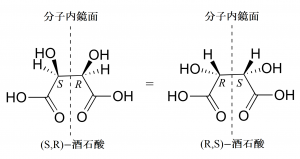
図20.酒石酸の分子内鏡面
このように分子内に鏡面を有する化合物はメソ体(またはメソ化合物)と呼ばれます。入試では鏡像異性体の数え上げにおいてひっかけ問題として時々出題されることがあるので注意しましょう。
● ● ●
ラセミ体について
以上、有機化合物を例に、不斉炭素原子を見てきました。
普通、何も考えずにキラルな有機分子を合成していくと、複数種類のエナンチオマーが混合した状態として得られます。これを「ラセミ体」と呼びます。エナンチオマーは構造が左右対称なだけで性質にはほとんど違いが無く、一度混ざると一方の化合物だけを取り出すことは非常に困難になってしまいます。
実際に有用な化合物は、エナンチオマーのうち片方だけであることが多いため、複数存在するエナンチオマーを選択的に合成する不斉合成技術が用いられます。不斉合成はキラルな構造をもつ触媒によって促進され、工業的に非常に価値の高い合成法となっています。この分野で先駆的な研究を行った野依良治氏は、2001年に「キラル触媒による不斉反応の研究」についてノーベル化学賞を受賞しています。野依氏は不斉触媒の一つであるBINAP触媒の効率的な合成法を確立し、BINAP触媒を用いた水素化反応を開発した功績が高く評価されています。
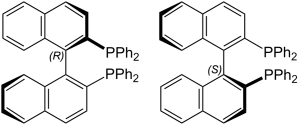
(おまけ①)不斉炭素原子を持たない鏡像異性体
ここからは高校レベルを超える内容になります。興味のある方だけ読んで下さい。
キラリティを有する有機分子には不斉炭素原子を持たないものも多く存在します。上述のBINAP分子にはR体とS体が存在しますが、不斉炭素原子を持っていません。このように不斉中心(有機分子なら不斉炭素原子)を持たず、回転軸によってキラリティを生じることを「軸不斉」と呼びます。
例えば、官能基を持たないビフェニルは軸不斉を示しませんが、置換基で装飾された6,6′-dinitro-2,2′-diphenic acidは軸不斉を有する化合物となります。これは中央のCーC結合が回転できないことに起因する不斉です。
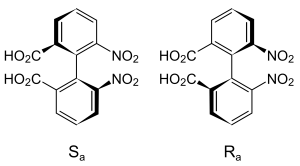
図22.6,6′-dinitro-2,2′-diphenic acid
また、面が回転できないことによって生じる「面不斉」も知られています。例えば、置換基を有するシクロファンの一種やフェロセン骨格を装飾した分子などは面不斉をもちます。
こうした単結合周りの回転が立体障害などによって阻害されることで不斉を示すタイプの異性体はアトロプ異性体(Atropisomer)と総称されます。アトロプ異性体は材料化学や有機合成といった研究分野で取り上げられることがあります。
また、「ヘリシティ」(螺旋性)によって不斉をもつ分子も存在します。最も分かりやすいのはヘリセン分子の例でしょう。
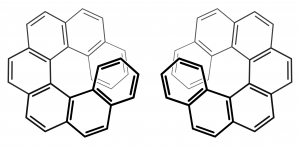 図23.ヘプタヘリセン([7]Helicene)
図23.ヘプタヘリセン([7]Helicene)
ベンゼン環が山型に3つ繋がったフェナントレンは螺旋を巻きませんが、テトラヘリセン([4]Helicene)からは立体障害のために上下に螺旋を巻き始めます。
また、2019年にScience誌にて報告された「オールベンゼンノット」というベンゼン環が24個連なった分子は「三葉結び目(Trefoil knot)」と呼ばれる構造を有するキラルな分子です。
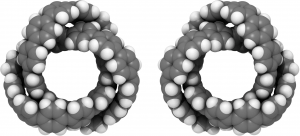
図24.オールベンゼンノット
ウロボロス的な見た目で、いかにも合成しにくそうな形の分子ですね! 実際、オールベンゼンノットの合成に成功した名古屋大学のトランスフォーマティブ生命分子研究所(ITbM)のウェブページによれば、収率はたったの0.3%だったそうです。ITbMを率いる伊丹教授は炭素同士を自由自在に繋ぎ合わせる合成技術の確立に力を入れて研究しています。近い将来、さらに驚くべき幾何学構造のナノカーボンが創られることでしょう!
(おまけ②)キラルな「無機化合物」
キラルな化合物は何も有機分子の専売特許というわけではありません。無機化合物にだってキラリティをもつものは数多く存在します。
八面体型錯体は二座配位子を2個以上持つ場合、キラリティが発生します。3回回転軸から見て、二座配位子が形成する螺旋構造が左回りのものは Λ(ラムダ)体、右回りのものは Δ(デルタ)体と呼ばれます。
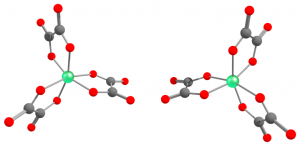 図25.$\ce{[Fe(ox)3]^3-}$の鏡像異性体
図25.$\ce{[Fe(ox)3]^3-}$の鏡像異性体
左:$\Lambda$-$\ce{[Fe(ox)3]^3-}$、右:$\Delta$-$\ce{[Fe(ox)3]^3-}$
また、四面体型錯体についてもキラリティを有するものが報告されています。下図に示すように、一般に四面体型錯体では立体反転が起きやすく、室温程度で容易にラセミ化(=エナンチオマーが混在した状態になること)してしまいます。ところが近年、東京大学の塩谷研究室により、巧みな配位子設計によって安定な四面体型亜鉛錯体が合成されました。
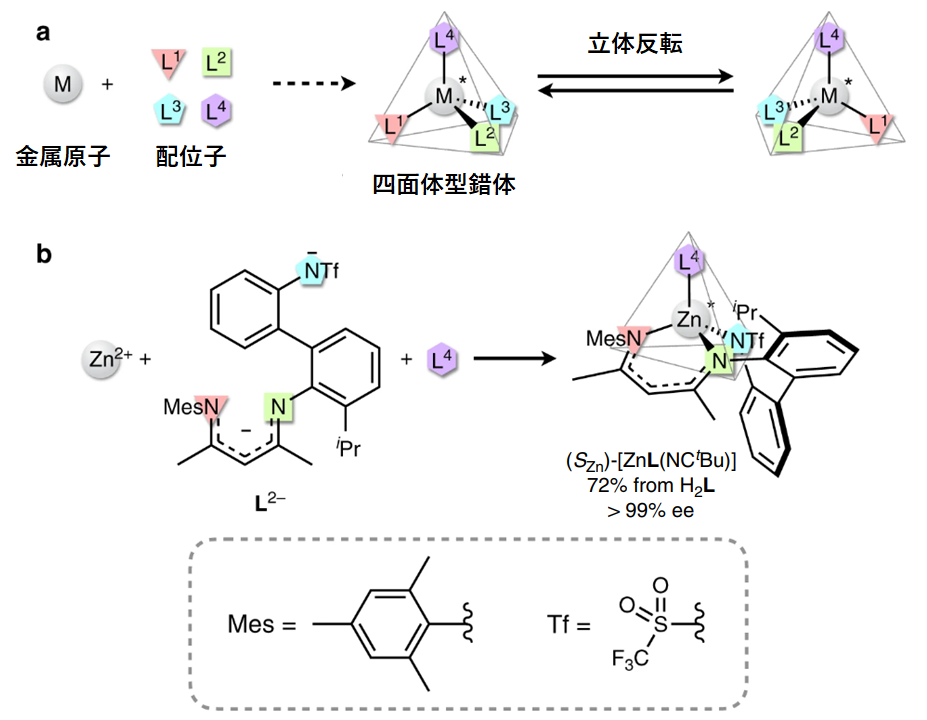 図26.キラリティをもつ四面体型錯体
図26.キラリティをもつ四面体型錯体
(CC BY 4.0の下で引用文献より一部改変して転載)
研究グループは図中bに示す亜鉛錯体の合成に成功し、70°Cで1週間加熱した後でも99%eeという高いエナンチオ純度を維持することを報告しています。また、この錯体はエナンチオ選択的なDiels-Alder反応の触媒として機能することも明らかになりました。このような安定な四面体錯体の合成例は、新しい不斉触媒の設計理論を拓く端緒となる重要な研究成果です。
Endo, K.; Liu, Y.; Ube, H.; Nagata, K.; Shionoya, M. Asymmetric construction of tetrahedral chiral zinc with high configurational stability and catalytic activity. Nat. Commun. 2020, 11, 6263, DOI: 10.1038/s41467-020-20074-7, (Open Access)
※コメント欄にて HY 様から四面体型錯体の合成例をご教示いただきました。情報提供に感謝いたします。
錯体だけでなく、結晶構造でもキラリティを生じることがあります。例えば、二酸化ケイ素(SiO2)のよく知られた結晶相である「石英」もキラルな構造を持っています。
下図の通り、石英の結晶構造は3回螺旋軸対称性を有しており、右巻き螺旋と左巻き螺旋の2種類が存在します。右巻き石英の空間群は$\rm{P}3_{1}21$、左巻き石英の空間群は$\rm{P}3_{2}21$となります。さらに、石英の高温相では熱的な揺らぎによって原子の配置が均整になるため、より対称性の高い構造(空間群は$\rm{P}6_{2}22$)をとることが知られています。
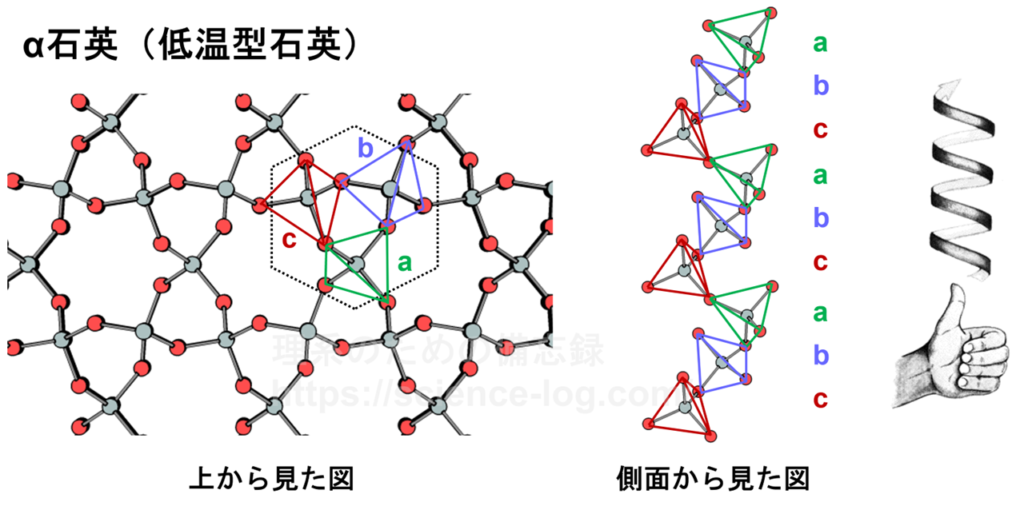 図27.左巻き型のα石英(SiO2)の結晶構造
図27.左巻き型のα石英(SiO2)の結晶構造
「不斉」という性質について一通り概観しました。キラルな化合物は化学的に面白い性質を多く持っているため、盛んに研究されています。人間の体の中にも様々なキラル化合物が存在し、中でもタンパク質は重要な化合物です。サリドマイドのように、R体とS体のうち片方だけが薬効を示す化合物は多く存在しており、人体に悪影響を与えない薬剤を合成するためにはee選択性の高い効率的な不斉合成法が必要不可欠です。不斉合成が可能になったおかげで皆さんは安全な薬を飲めて、美味しいものが食べられる世の中になっているのです。

おまけ②のキラルな無機化合物についてですが、四面体型錯体でもキラルな錯体が報告されています(Shionoya 2020)。一般的に四面体型錯体では立体反転が起きやすくすぐにラセミ化しますが、配位子をうまく設計することで安定な四面体型錯体の合成に成功したというものです。
HY さん
初めまして、管理人のpencilです。コメントありがとうございます。
こちらの論文ですね!
K. Endo, Y. Liu, H. Ube, K. Nagata, M. Shionoya, Nat. Commun. 2020, 11, 6263/1-7.
早速記事中に反映させていただきました。情報提供に感謝いたします。
今後とも当サイトをよろしくお願いします(^▽^)