「はみ出し高校化学シリーズ」と題して教科書には載っていないであろう余計な豆知識をご紹介していきます。本企画の第2弾は有機化学でお馴染みのニトロ基NO2の構造を取り上げます。化学に興味のある高校生・大学生向けの記事です。
ニトロ基 NO2
NO2という組成式で表される置換基を「ニトロ基」といいます。
高校化学では有機化学の分野でニトロベンゼンなどとして登場する置換基ですね。硫酸と硝酸からなる混酸中で反応させることにより、芳香環にニトロ基を導入することができます。
ニトロベンゼンは以下のような構造をしています。
ニトロ基は1個くらいなら不安定ではないのですが、多数のニトロ基(あるいは硝酸エステル)を有するニトロ化合物は爆発性を持つ場合があります。例えばトリニトロトルエン(TNT)、ピクリン酸、ニトログリセリンなどは爆薬として用いられることがあります。
芳香環にニトロ基を導入すると$\pi$軌道の共役という現象によってHOMO(最高被占軌道)が安定化し、短波長側の領域(ニトロベンゼンでは 250 nm ~ 270 nm の領域)に吸収帯を持つようになります。そのため、多くのニトロ芳香族は黄色を呈色します。ニトロ基が関係する有名な反応で言うと「キサントプロテイン反応」が挙げられます。硝酸が皮膚に付着すると黄色に変色してしまいます。これは皮膚を構成するタンパク質に含まれる芳香環がニトロ化されたことによるものです。これをキサントプロテイン反応と呼んでいます。
最近の漫画だと『Dr.STONE』にコウモリの糞から硝酸を得るシーンがあります。アニメ版では硝酸に触れた指がちゃんと黄色っぽくなっています。
トリニトロトルエンはかつては黄色の染料として利用されていましたが、その後に爆薬としての価値が見出され、大量生産されるようになります。一方でニトログリセリンは衝撃や振動をほんの少し与えるだけでガラスのビーカーが飛散するほどの威力があり、発見当初は危険すぎて爆薬としては不向きとされていました。その後のアルフレッド・ノーベルらによる度重なる改良の末、ダイナマイトとして実用化されたのは有名な話ですよね。
ニトロ基の構造式
高校化学の問題ではよく構造式の例が問題文中に描かれていますが、大抵はニトロ基の構造式が描かれていません。描かれていたとしてもNO2のように省略形で描かれていることがほとんどです。それが何故なのか疑問に思ったことはありませんか?
実はNO2の構造を理解するには高校化学の範囲では説明されていない「共鳴」という概念が必要になります。
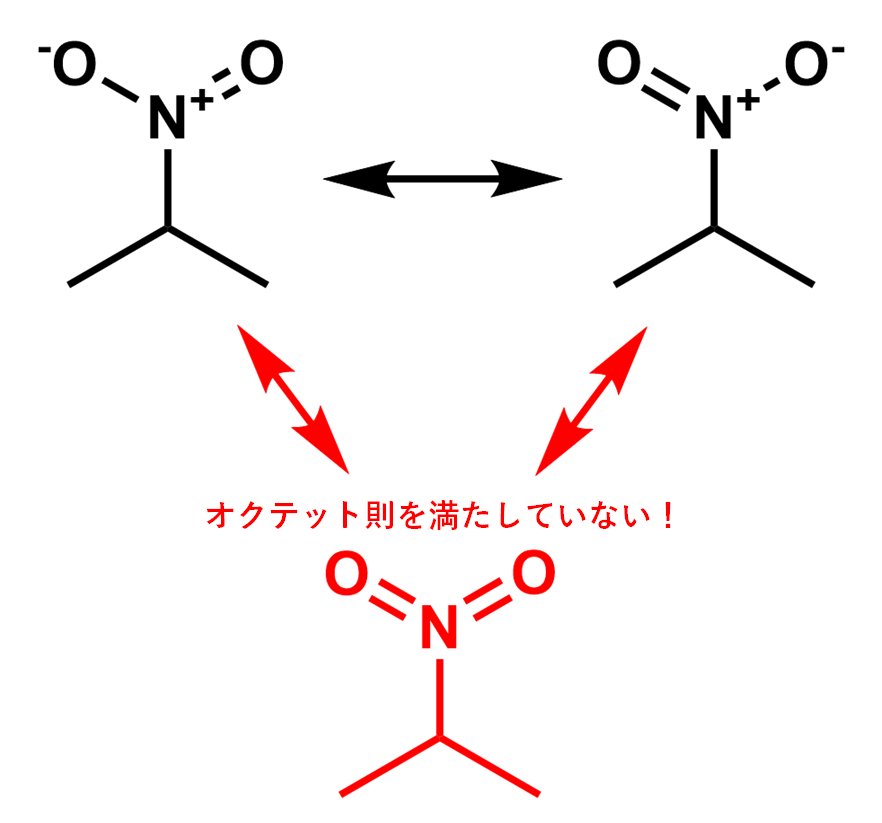
結論から言うと、ニトロ基は以下のような状態で存在しています。正確には、以下の2つの状態の「重ね合わせ」として存在しています。

電荷が2つ存在していて何だかよく分からない構造に見えるかもしれません。実際には左側の構造と右側の構造を行ったり来たりしつつ、ちょうど中間くらいの構造で存在しています。このような構造式を「共鳴構造式」とか「極限構造式」などと呼びます(これは完全に大学範囲の化学なので高校生の皆さんは覚えなくても構いません)。
なぜ$+$と$-$の2つの電荷があるのかというと、窒素原子は5本の結合手(価標)を持てないためです。窒素原子には最外殻に5つの電子があります。これを価電子と言います。この5つの価電子と相手の原子との間で電子を共有して「共有結合」を作ります。
仮に窒素が5本の結合手を持ったとすると、窒素原子の最外殻には10個の電子が入らなければなりません。しかしL殻には8個の電子しか入れないため、これでは電子が溢れてしまいます。そのため、窒素原子は5本の結合手を持たないのです。因みにこの経験則は「オクテット則」と呼ばれており、大抵の場合で成り立ちます。
つまり、ニトロ基は以下のようなイメージで捉えることができます。これは共鳴構造式の重ね合わせになっています。
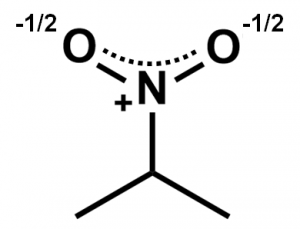
しかし高校の有機化学でも大学の有機化学でもこんな描き方は普通はしません。あくまでもこのように存在しているというイメージを持ってもらうために無理やり描いているだけです。こうした事情があるのでニトロ基は原子を1個ずつ描くのではなく、まとめてNO2のように省略形で描くのが一般的なのです。
…というわけで、良い子の皆さんは必要な時以外、ニトロ基の構造式を
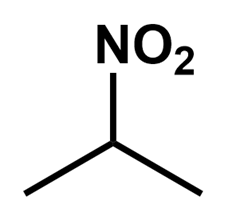
と描くようにしましょう。
ニトロ基が電子求引性の置換基なのは根元の窒素原子が電子不足になっているからです。このことは共鳴構造を考えないと説明が難しいですね。芳香環のニトロ基がメタ配向性を示すのも共鳴構造を考えれば理解できます。
