立体障害により単結合が自由に回転できないために生じる構造異性体を「アトロプ異性体」と呼びます。今回はこのアトロプ異性体についてまとめました。
アトロプ異性体について
不斉炭素原子が存在する分子にはエナンチオマー(鏡像異性体)が存在しますが、不斉炭素原子を持たないにもかかわらず異性体が存在し、光学活性を示す化合物が知られています。
単結合は普通、自由に回転することができます。しかし、回転に何らかの活性化障壁が存在する場合は「軸不斉」が生じます。
例えば、ベンゼンが2つ繋がったビフェニル分子は単結合が自由に回転可能(障壁は数kJ/mol程度[1])ですが、ベンゼンに置換基が生えている場合は回転のバリアが大きくなります。その活性化障壁が室温で超えられないくらい高ければ、各コンフォマーを別々の分子として取り出すことができます。
[1] F. Grein, J. Phys. Chem. A 2002, 106, 15, 3823–3827
アトロプ異性体の例
最も有名なアトロプ異性体は、2001年にノーベル化学賞を受賞した野依良治教授らが開発したBINAPでしょう。
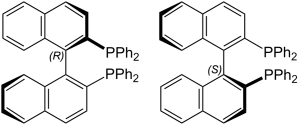
BINAPはかさ高いジフェニルホスフィノ基($\text{PPh}_2$)による立体障害のために軸不斉を生じており、アトロプ異性体となります。これは不斉合成において広く利用されている不斉配位子で、工業的に非常に重要な価値を持った触媒です。
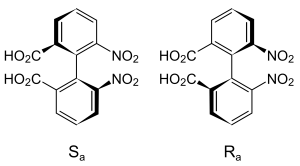
ニトロ基とカルボキシル基を2つずつ有する6,6′-ジニトロジフェン酸の場合、$S_a$と$R_a$という2つの配座は、高い回転障壁のために区別することができます。したがって、これらのコンフォマーはアトロプ異性体となります。
アトロプ異性体の単結合は本当に回転しないの?
でも、いくら立体障害があるといっても無理やり回転すればできないこともないのでは?
・・・そう思っている方のために、計算化学の力を借りて検証してみました!
【例1】6,6′-ジニトロジフェン酸
(IUPAC名:2-(2-carboxy-6-nitrophenyl)-3-nitrobenzoic acid)
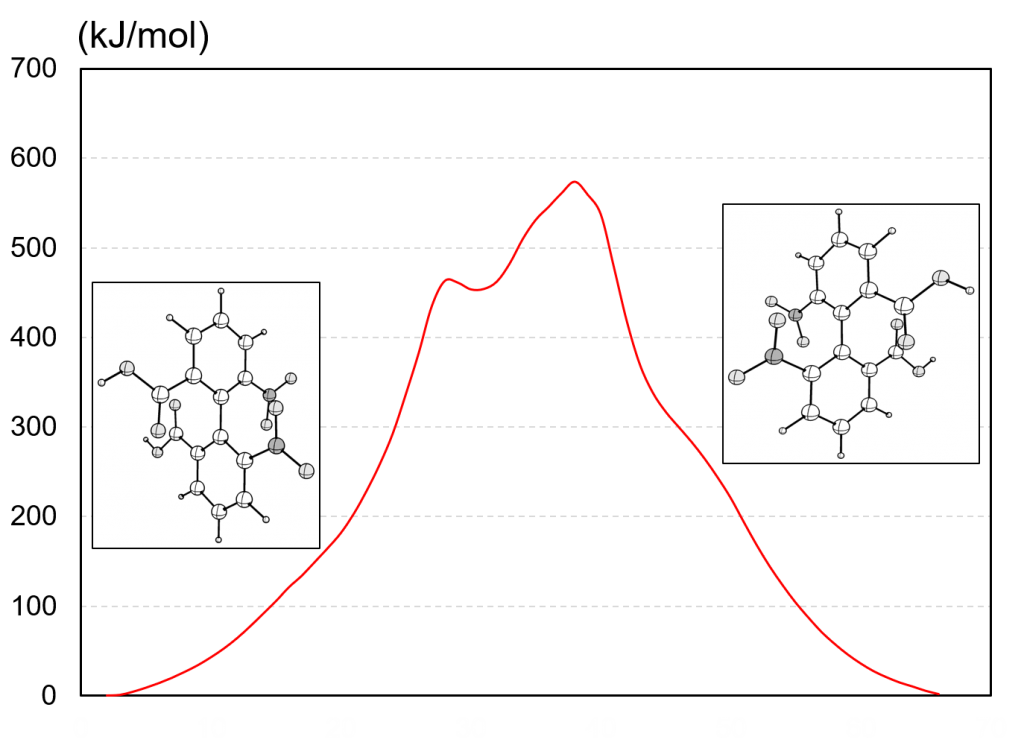
B3LYP/6-31Gレベルで反応経路を計算した結果、回転障壁は何と 570 [kJ/mol] にまで及ぶことが分かりました。室温で超えられる障壁は約 100 [kJ/mol] なので、$S_a$体と$R_a$体は加熱や光照射でもしない限り、相互変換がほぼ不可能だと言えます。やはりニトロ基とカルボキシル基ではどうしてもぶつかり合いが起きてしまい、バリアが高くなってしまうようです。
では、もっと小さい置換基の場合はどうでしょうか?
【例2】6,6′-ジフルオロ-2,2′-ジメチルビフェニル
(IUPAC名:1-fluoro-2-(2-fluoro-6-methylphenyl)-3-methylbenzene)
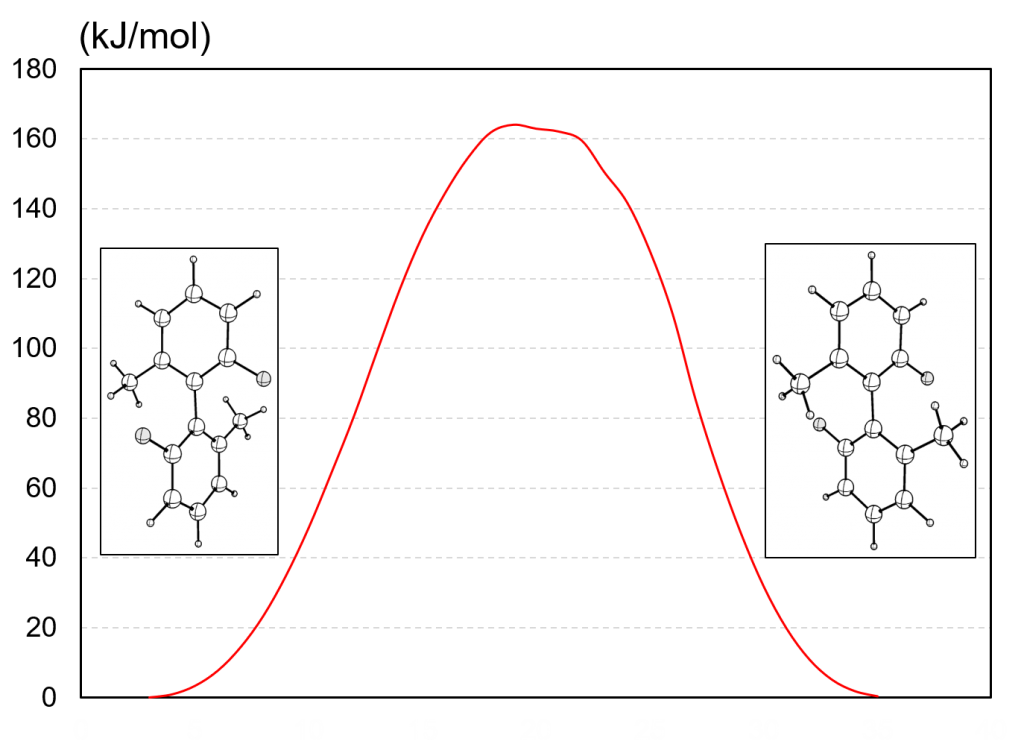
B3LYP/6-31Gレベルで同様に計算した結果、回転障壁はおよそ 160 [kJ/mol] になりました。メチル基があるだけでも室温では超えられないほど回転障壁が高いのですね!
アトロプ異性体は軸不斉によって生じますが、他にも面不斉や螺旋不斉など知られています。不斉そのものについてより詳しくは知りたいという方は「不斉って何?不斉炭素原子とは?」のページを是非ご覧下さい!

“アトロプ異性体について” への6件の返信