本稿では有機化学実験で用いられるTLC(薄層クロマトグラフィー)の原理とRf値の計算方法や意味について分かりやすく解説します!
TLCについて
「TLC」とは “Thin-Layer Chromatography” の略で、「薄層クロマトグラフィー」のことを指しています。ガラスの板の上にシリカゲル、アルミナ、ポリアミド樹脂などを薄く張ったTLCプレートを用いて物質の定性を行うクロマトグラフィーを薄層クロマトグラフィーといいます。
TLCは化合物の物性の確認や、化学反応の進行度合いを確認するために利用される分析手法です。TLCによって化合物を簡便に同定することができるため、有機化学の実験で頻繁に用いられています。
具体的には、TLCプレートの表面に原料や生成物の液滴をスポットし、溶媒に浸して展開させます。展開溶媒にはヘキサンと酢酸エチルの混合溶液が用いられることが多いですが、基本的には化合物が展開できればどんな溶媒でもOKです。ただし先行研究で報告されている化合物を同定する場合は論文に記載されている溶媒を使います。
展開溶媒にTLCプレートの表面には原料や生成物の液滴を下図のようにスポットします。プレート上に原点の位置を決め、原料、生成物をスポットします。このとき原料と生成物の両方を重ね打ちしたスポットも用意します(理由は後述)。
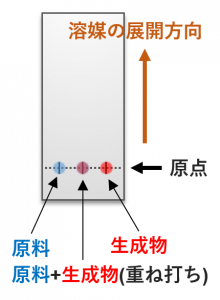
図では原料と生成物の2種類しかスポットしていませんが、高分離能のTLCプレートを使えば一度に複数の化合物を展開させることもできます。学生実験レベルでは2種類の化合物をスポットする最も簡便な方法を採用することが多いです。
出来上がったTLCプレートは、プレートの底面が水平になるようにして展開溶媒に静かに浸します。溶媒がある程度の位置まで展開されたらプレートを引き上げて乾燥させ、アニスアルデヒド溶液などの発色剤に浸けてからヒーターで炙ってから紫外線を照射してスポットを確認します。
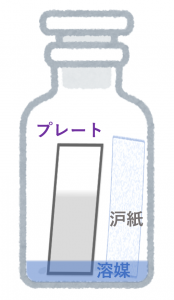
なお、TLCで溶媒を展開する前に、展開溶媒に浸した沪紙を容器の中に入れておきます(大きければ切って入れる)。この沪紙は、容器内で展開溶媒の気液平衡が保たれるようにするためのものです。TLCにおいて溶媒は毛細管現象によってプレート表面の担体に浸み込んで上昇しますが、このときプレートから展開溶媒が蒸発してしまうと正確な展開距離が測定できません。そのため、容器の中に沪紙を入れて展開溶媒の蒸発を防ぐ必要があるのです。TLCで溶媒を展開する際にいちいち容器を密閉するのは、容器内の気液平衡が保たれるようにするためです。
展開後のTLCプレートは下図のようになります(試料の展開位置は適当に図示しています)。TLCでは化合物と吸着剤の相互作用の強さの違いを利用して試料を分離します。矢印は試料が展開した距離を表しています。
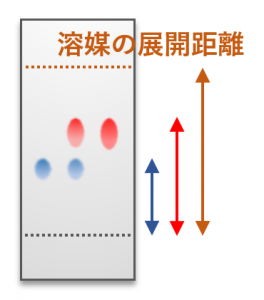
シリカゲルなどの吸着剤が塗布されたガラスやアルミの板の下部を溶媒に浸すと、毛細管現象によって溶媒が板の上部に向かって浸透していきます。このとき、溶媒に引きずられてスポットした原料や生成物も移動します。
TLCに限らずクロマトグラフィー全般に言えることですが、吸着剤と化合物の相互作用が強い(より強く吸着する)ほど化合物の移動速度は遅くなります。吸着剤との相互作用の強さは化合物によって異なるため、プレート上で化合物を分離することができるのです。
このようにして、TLCの結果から「ちゃんとモノは取れたかな?」とか「反応液に原料は残っていないかな?」などなどについて考察します。
Rf値の計算方法と特徴
TLCで使われる「Rf値」という単語ですが、これは “retention factor value” を指しています。”retention” は「保持」の意なので、溶媒で展開した際に化合物がどれだけ保持されたか(運ばれたか)を数値化したものと言えます。
Rf値は次のように計算できます。$$\text{Rf値}=\dfrac{\text{スポットの移動距離}}{\text{溶媒の移動距離}}$$Rf値が$1$に近いほど、吸着材との相互作用が弱く、展開溶媒に乗って長距離を運ばれたと言えます。反対にRf値が$0$に近いほど、吸着材と強く相互作用し、展開溶媒に運ばれにくいことが分かります。
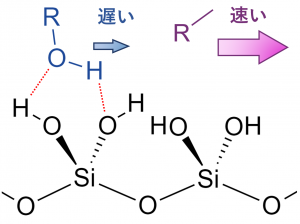
Rf値の大小はRf値の大小は化合物の極性によって変わります。分子の極性(双極子モーメント)が大きいほど水素結合を作りやすく、吸着剤のシリカと強く相互作用するため、展開速度が遅くなりRf値は小さくなります。逆に、極性が小さければ水素結合を作りにくくなるので、シリカとの相互作用は弱くなります。 従って極性の小さい化合物ほど展開溶媒に乗って長距離を運ばれるため、Rf値は大きくなります。
ここで、展開させる試料のRf値が近かったり、溶媒が斜めに展開してしまったりすると、原料と生成物の2つのスポットのRf値が正しく測れているか判断できません。例えば原料と副成物のRf値が近い場合、本当は反応しきっているのに反応が終わっていないと勘違いしてしまう恐れがあります。こうした事態を防止するため、TLCプレートの真ん中にスポットを重ね打ちしています。
Rf値の解釈
例えば、TLCの結果が下の図のようになったとしましょう。原料は青色、生成物は赤色のスポットで、$d_{\mathrm{R}}$、$d_{\mathrm{P}}$、$d_{\mathrm{S}}$はそれぞれ原料、生成物、溶媒の移動距離を表しています。
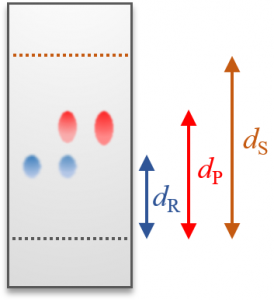
このときRf値について $\dfrac{d_{\mathrm{R}}}{d_{\mathrm{S}}}<\dfrac{d_{\mathrm{P}}}{d_{\mathrm{S}}}$ が成り立つので、原料よりも生成物の方が極性が低く、吸着剤との相互作用が弱い(=長距離を移動している)ことが分かります。上図の例では、原料に存在していたヒドロキシ基やカルボキシ基などの極性の高い官能基が、生成物では変換もしくは除去できたことの根拠としてRf値が利用できます。
TLCからは物質の極性以外にも色々な情報が得られます。例として下図のような結果が得られた場合について考えてみましょう。
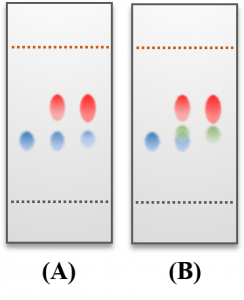
(A)では原料である青色のスポットが、重ね打ちをしていないはずの反応液のスポットにも現れています。これは、反応が完全には進行せず原料が残っていることを意味しています。
また、(B)では右側の反応液のスポットが2つに分かれています。これは反応が進んだ結果、主生成物(赤色スポット)の他にも副生成物(緑色スポット)が得られていると考えられます。
このように、TLCを用いることで化合物の物性を確認できるだけでなく、化学反応の進行度合いを確認することもできるのです。
TLCは簡便であると同時に多くの情報を得ることができる分析手法で、有機合成実験では頻繁に利用されています。TLCの結果の見方を正しく理解しておくことは実験を成功させるためにも重要です。
