光(紫外線)を照射するとアルカンをハロゲン化することができます。これはハロゲン分子を光開裂することで進行するラジカル反応です。本稿ではこの反応機構についてまとめました。
水素と臭素の反応
水素と臭素の混合気体に光を照射することによって、$\text{HBr}$分子を得ることができます。これは臭素分子の光開裂によって臭素ラジカルが生じることで起こる反応で、大学院の入試問題としても頻繁に扱われています(例えば、青山学院大学大学院の理工学研究科の2020年度9月入学試験などに出題されています)。
臭素-臭素間結合($\text{Br-Br}$)の結合解離エネルギーはおよそ 190 kJ/mol 程度であり、これは大体 2 eVくらいのエネルギーに対応します。これと同等のエネルギーを持つ光の波長は約 630 nm です。
実験的に観測される気体臭素分子の吸収スペクトルは 430 nm 辺りで極大となります(下図参照)。
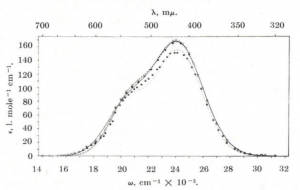
したがって、臭素が効率良く吸収できる波長域の光は、臭素-臭素間結合を開裂するのに十分なエネルギーをもっています。この波長の光(可視光)は太陽光の成分として含まれているので、臭素を太陽光にさらすと勝手に分解してしまいます(蛍光灯の光でも分解が進みます)。
一連のラジカル反応は以下の素反応(「素過程」とも言います)からなっています。
開始反応$$\mathrm{Br}_{2} \stackrel{k_{1}}{\longrightarrow} \mathrm{Br}^{\bullet} + \mathrm{Br}^{\bullet}$$
伝搬反応$$\begin{cases}\mathrm{Br}^{\bullet}+\mathrm{H}_{2} \stackrel{k_{2}}{\longrightarrow} \mathrm{HBr}+\mathrm{H}^{\bullet} \\
\mathrm{H}^{\bullet}+\mathrm{Br}_{2} \stackrel{k_{3}}{\longrightarrow} \mathrm{HBr}+\mathrm{Br}^{\bullet}\end{cases}$$
抑制反応$$\mathrm{H}^{\bullet}+\mathrm{HBr} \stackrel{k_{4}}{\longrightarrow} \mathrm{H}_{2}+\mathrm{Br}^{\bullet}$$
停止反応$$\mathrm{Br}^{\bullet}+\mathrm{Br}^{\bullet} \stackrel{k_{5}}{\longrightarrow} \mathrm{Br}_{2}$$
ここで”$\bullet$” は不対電子を表しており、ラジカル種であることを明示しています。抑制反応には$\mathrm{H}^{\bullet}$が関与する反応のみが書いてありますが、これは$$\mathrm{Br}^{\bullet}+\mathrm{HBr} \longrightarrow \mathrm{Br}_{2}+\mathrm{H}^{\bullet}$$という反応が吸熱的であり、$\mathrm{H}^{\bullet}+\mathrm{HBr}$ に比べてほとんど無視できる速度でしか進行しないためです。
この系の反応速度は定常状態近似を用いることで解析的に求めることが可能です。中間体であるラジカル種に定常状態近似を適用すると以下のようになります。$$\scriptsize \begin{cases}
\dfrac{d[\mathrm{Br}^{\bullet}]}{d t}=2 k_{1}\left[\mathrm{Br}_{2}\right]-k_{2}[\mathrm{Br}^{\bullet}]\left[\mathrm{H}_{2}\right]+k_{3}[\mathrm{H}^{\bullet}]\left[\mathrm{Br}_{2}\right]+k_{4}[\mathrm{H}^{\bullet}][\mathrm{HBr}]-2 k_{5}[\mathrm{Br}^{\bullet}]^{2}=0 \\ \dfrac{d[\mathrm{H}^{\bullet}]}{d t}=k_{2}[\mathrm{Br}^{\bullet}]\left[\mathrm{H}_{2}\right]-k_{3}[\mathrm{H}^{\bullet}]\left[\mathrm{Br}_{2}\right]-k_{4}[\mathrm{H}^{\bullet}][\mathrm{HBr}]=0 \end{cases}$$これらの式から、$$\small \begin{align}
2 k_{1}\left[\mathrm{Br}_{2}\right] &= 2 k_{5}[\mathrm{Br}^{\bullet}]^{2} \\
\therefore [\mathrm{Br}^{\bullet}]_{\mathrm{ss}} &= \left(\frac{k_{1}}{k_{5}}\left[\mathrm{Br}_{2}\right]\right)^{\frac{1}{2}}
\end{align}$$を得ます。ここで添え字の “ss” は “steady state”(定常状態)に由来しています。
同じようにして定常状態の水素ラジカルの濃度は$$\small [\mathrm{H}^{\bullet}]_{\mathrm{ss}}=\dfrac{k_{1}\left(\dfrac{k_{2}}{k_{5}}\right)^{\frac{1}{2}} \left[\mathrm{H}_{2}\right]\left[\mathrm{Br}_{2}\right]^{\frac{1}{2}}}{k_{3}\left[\mathrm{Br}_{2}\right]+k_{4}[\mathrm{HBr}]}$$となります。
$\mathrm{HBr}$の生成速度は次式で与えられます。$$\small \dfrac{d[\mathrm{HBr}]}{d t}=k_{2}[\mathrm{Br}^{\bullet}]\left[\mathrm{H}_{2}\right]+k_{3}[\mathrm{H}^{\bullet}]\left[\mathrm{Br}_{2}\right]-k_{4}[\mathrm{H}^{\bullet}][\mathrm{HBr}]$$これはそのまま代入すると計算が大変なので定常状態近似の2番目の式を上手く使って解きます。結果は$$\small \dfrac{d[\mathrm{HBr}]}{d t}=2 k_{3}[\mathrm{H}^{\bullet}]\left[\mathrm{Br}_{2}\right]=\dfrac{2 k_{2}\left(\dfrac{k_{1}}{k_{5}}\right)^{\frac{1}{2}}\left[\mathrm{H}_{2}\right]\left[\mathrm{Br}_{2}\right]^{\frac{1}{2}}}{1+\dfrac{k_{4}}{k_{3}}[\mathrm{HBr}]\left[\mathrm{Br}_{2}\right]-1}$$となります。
光照射によるメタンの塩素化
水素と塩素の反応は上記の機構と同じように進行しますが、塩素分子の場合は解離エネルギーが臭素分子に比べて大きいので開始反応が起こりにくくなります。
開始反応$$\small (1) \quad \mathrm{Cl\!-\!Cl} \stackrel{h \nu}{\longrightarrow} 2 \mathrm{Cl}^{\bullet}$$
伝搬反応$$\small (2) \quad \mathrm{Cl}^{\bullet}+\mathrm{CH_3\!-\!H} \longrightarrow \mathrm{H\!-\!Cl}+\mathrm{CH_3}^{\bullet} $$ $$\small (3) \quad \mathrm{CH_3}^{\bullet}+\mathrm{Cl\!-\!Cl} \longrightarrow \mathrm{CH_3\!-\!Cl}+\mathrm{Cl}^{\bullet}$$
抑制反応$$\small (4) \quad 2 \mathrm{Cl}^{\bullet} \longrightarrow \mathrm{Cl\!-\!Cl}$$
停止反応$$\small (5) \quad \mathrm{CH_3}^{\bullet} + \mathrm{Cl}^{\bullet} \longrightarrow \mathrm{CH_3\!-\!Cl}$$ $$\small (6) \quad 2 \mathrm{CH_3}^{\bullet} \longrightarrow \mathrm{CH_3\!-\!CH_3}$$
$(3)$式で生成したクロロメタンに対して$(2)$式や$(3)$式と同様の連鎖機構でさらに塩素化が起こり、ジクロロメタン、トリクロロメタンなどが生成します。
