ほとんどの大学では大学初年度の科学実験の授業の中でpHの測定やpH滴定曲線のプロットをやるのではないでしょうか。
滴定実験は実験器具の扱いやデータの取り方などを学ぶ上で基礎中の基礎となる化学実験と言えます。もしかしたら中学校や高校で既に経験している人もいるかもしれませんね。私が高校時代にやった化学実験と言えば、過マンガン酸カリウムの酸化還元滴定の実験くらいしか記憶にありませんが・・・。
トップ画像を変えました。
お気付きの方も多いかと思いますが、各種pHの水溶液についてBTB指示薬を滴下したビーカーを並べたものです。こうして見るとなかなか綺麗です。一部ホコリのようなものが写っていますが(笑)。
BTB指示薬とは酸性~黄色、中性~緑色、塩基性~青色とpHによって異なる色を呈する便利な薬品です(非常に強い酸では赤色、非常に強い塩基では紫色を示す)。BTB指示薬自体はものすごく濃い緑色をしており、かなり黒く見えます。
確かこの実験のときは中和滴定も一緒に行ったように記憶しています。実験というものをまともにやったことがなく、慣れない実験ノートやレポートに相当手こずり大変な思いをしましたが、当時のテキストを見ると何だか懐かしくなります。
ブロモチモールブルー(英: bromothymol blue, BTB)はC₂₇H₂₈Br₂O₅Sという分子式で表され、以下のような構造をしています。
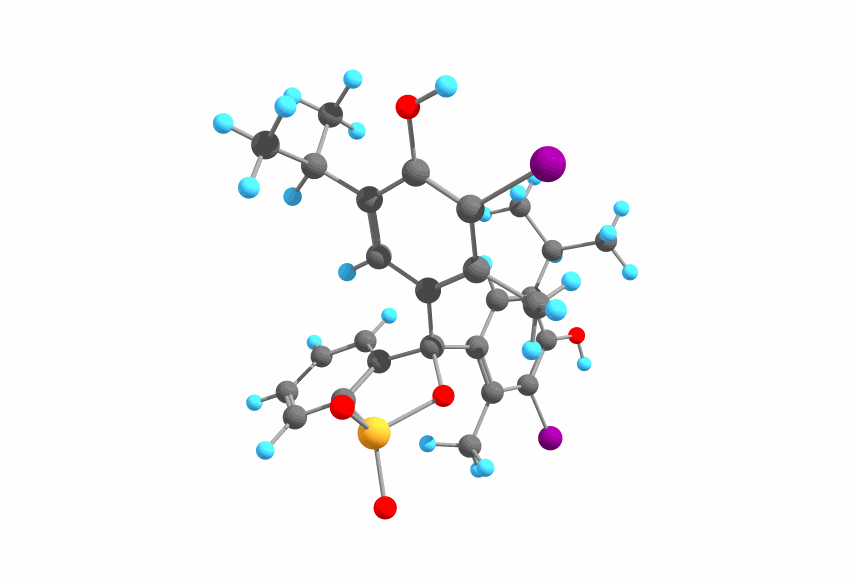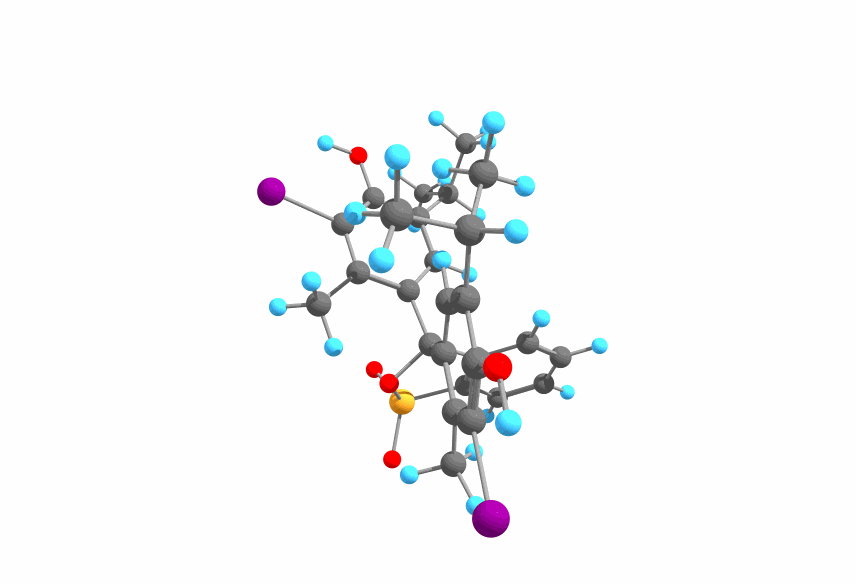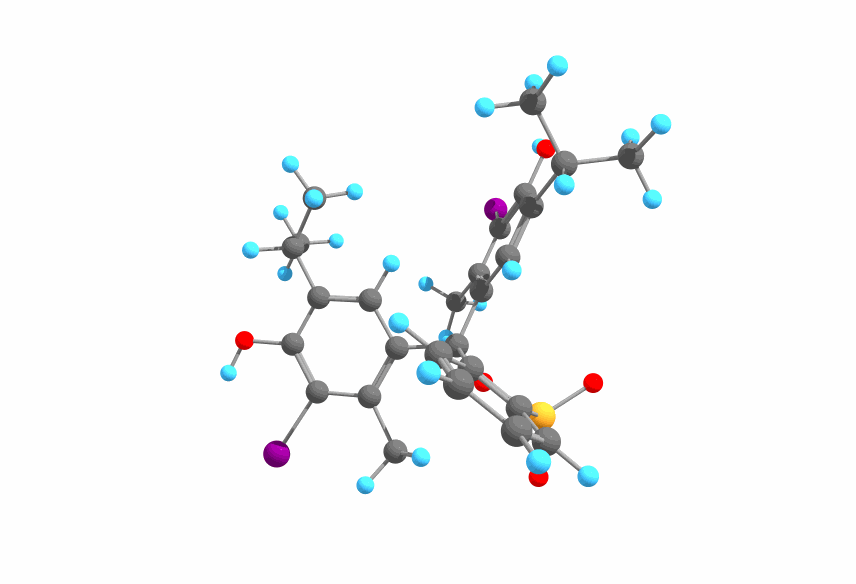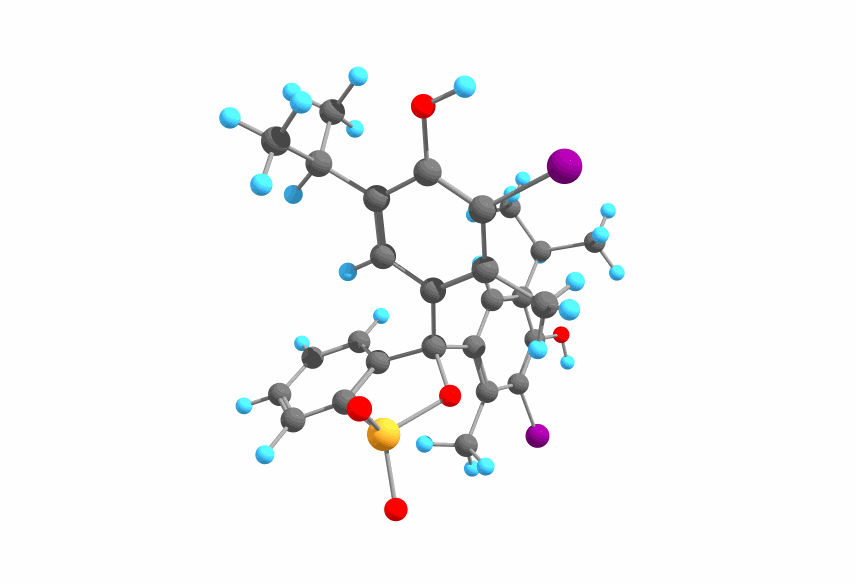 図1.BTBの構造
図1.BTBの構造
BTBの立体構造なんて多分どの教科書にも載っていないと思いますので、しかとご鑑賞下さい(笑)。なお、このgifアニメーションは管理人がChemcraftというソフトウェアを用いて自作したものです。
図1に示した構造はフェノール部分が2カ所とも脱プロトン化していないので、pHが小さい条件、即ち酸性条件下における構造ということになります。
 図2.BTBの化学平衡
図2.BTBの化学平衡
BTBは液性によって大きく構造変化し、それに伴って発色も変化します。
大学レベルの説明をすると、プロトン化したBTBは427 nm(これは青色の光です)に吸収極大をもつため、酸性溶液中では補色である黄色の光を反射します。一方で、脱プロトン化したBTBは602 nmの光(これは橙色の光です)を最もよく吸収するため、塩基性溶液中では青色の光を反射します。(※Wikipediaの日本語ページには誤った吸収波長が記載されているので注意)
普通はこの程度の理解で良いと思いますが、さらに詳しく説明すると以下のようになります。
塩基性条件下ではBTBの化学平衡が図2で言うと右側に偏るため、分子内の広い範囲に$\pi$共役系が広がった構造をとります。一般に$\pi$共役系が広がると最高被占分子軌道(HOMO)と最低空分子軌道(LUMO)のエネルギー差は小さくなり、分子はより小さいエネルギー差に対応する波長の光を吸収するようになります。ここで、$$E=h\nu =h{\dfrac{c}{\lambda}}$$の関係式から、エネルギー$E$と波長$\lambda$は反比例することが分かりますので、$\pi$共役系が広がれば、より長い波長の光を吸収するようになることが定性的に説明できます。実際に、脱プロトン化したBTB(図2の右側の構造)の最大吸収波長は602 nmで、427 nmに比べて長くなっています。そのためBTBはpHによって吸収波長が変わり、しかもpHと発色が1対1に対応しています(=吸収波長がpHの関数になっている)。BTBがpH指示薬として利用できるのはこういう理由からだったのです。
BTB試薬の使い方については周知の通りだと思いますので、あまり詳しくは解説しません。一応、変色域を図3に示しておきます。
 図3.BTB試薬の変色域
図3.BTB試薬の変色域
BTB試薬に並ぶ有名なpH指示薬としてフェノールフタレインが知られていますね。実はこれも$\pi$共役系の広がりが発色に関係しています。興味のある方は是非調べてみて下さい。
pH(水素イオン指数)について、詳しくは以下の記事をご覧下さい!
